Soluzioni
Servizi
Area tecnica

Via Enrico Mattei, 3
20037 Paderno Dugnano (MI)
Definizione: Composto chimico in grado di eliminare, dopo il trattamento, i microorganismi presenti su materiale inerte, con la sola eccezione di alcune spore batteriche. Affinché l’azione disinfettante sia efficace è necessaria la preventiva pulizia delle superfici, poiché la presenza di materiale organico diminuisce o annulla il potere disinfettante del composto.
I disinfettanti vengono divisi in tre diversi livelli, in base al loro potere disinfettante:
| Microorganismi | Livello Alto di attività | Livello Medio di attività | Livello Basso di attività |
|---|---|---|---|
| Batteri vegetativi | + | + | + |
| Micobatteri | + | + | - |
| Endospore batteriche | + | - | - |
| Funghi | + | + | +- |
| Virus lipofili | + | + | +- |
| Virus idrofili | + | + | - |
| Spore fungine | + | + | - |
La disinfezione dell’aria può essere effettuata mediante due diverse metodiche:
L’aerosolizzazione deve essere impiegata solo per la disinfezione terminale degli ambienti, ed in particolare per quanto riguarda l’ambito ospedaliero deve essere effettuata solo negli ambienti che hanno ospitato pazienti con TBC, meningite meningococcica o, affetti da malattie respiratorie virali.
L’aerosolizzazione è una metodica che permette di disperdere nell’aria micelle di disinfettante del diametro compreso tra 0,5 e 5 micron. In tal modo si forma un aerosol di disinfettante che:
le superfici con le quali viene a contatto, perché la particella aerosolica possiede una tensione superficiale tale da rappresentare una microscopica palla rimbalzante che non scoppia al contatto con le superfici.
Inoltre tali micelle sono talmente leggere da non risentire quasi della forza di gravità che tenderebbe a farle precipitare in basso. In tal modo permangono a lungo nell’aria svolgendo in maniera più prolungata ed efficace la loro azione microbicida. Un altro aspetto importante è la carica elettrica delle micelle che deriva soprattutto dal metodo di formazione dell’aerosol in conseguenza dei fenomeni di attrito e sfregamento all’atto della micronizzazione; è appunto questa carica elettrica sempre dello stesso segno che, unitamente ai fenomeni di vibrazione delle singole goccioline, rende possibile la stabilità della sospensione nel tempo. L’aerosolizzazione è, pertanto, una procedura che consente una maggiore dispersione delle sospensioni nell’ambiente, un minor consumo di disinfettante e un costo minore delle operazioni di disinfezione.
La nebulizzazione invece disperde nell’ambiente goccioline di diametro in genere superiore ai 30 micron, che tendono a precipitare più rapidamente al suolo. Per tale ragione è una procedura di minor efficacia.

La disinfezione dell’aria può inoltre essere effettuata sia con sistemi a freddo che con sistemi a caldo; generalmente si ritiene che con i sistemi a caldo prodotti dagli impianti definiti “termonebbiogeni” le operazioni di diffusione e micronizzazione delle particelle in sospensione di disinfettante sia più veloce e soprattutto completa ed efficiente rispetto ai sistemi di distribuzione a freddo.
Il trattamento mediante termonebulizzazione, cioè a caldo, consente infatti di saturare gli ambienti più velocemente (le particelle insieme al calore salgono più velocemente) anche se poi raffreddandosi tendono a scendere.
In generale, si può affermare che più sono piccole le dimensioni delle particelle (diametro) più sarà secca la nebbia che si produce e conseguentemente bagnerà di meno le superfici e gli ambienti con cui andrà in contatto.
Il meccanismo di funzionamento degli aerosol disinfettanti passa attraverso due successive fasi:
I disinfettanti possono essere suddivisi in diverse famiglie, sulla base dei loro componenti principali:
Di seguito si propone una classificazione dei virus effettuata sulla base delle dimensioni e della presenza o assenza di lipidi nella membrana citoplasmatica, caratteristica che determina la suscettibilità del virus ai disinfettanti:
Un relativamente esiguo numero di disinfettanti è efficace contro grandi gruppi di virus e batteri. Pertanto, la scelta del disinfettante dipende dall’agente patogeno, dalla disponibilità del disinfettante, dalla modalità con cui il disinfettante può essere applicato e dal tempo di contatto che il disinfettante necessita per espletare la sua azione.

I principali tipi di disinfettanti inorganici sono:
sono composti che liberano O₂. Nel processo ossidativo la composizione cellulare viene ad essere alterata con una conseguente azione disinfettante.
Ha bassa tossicità ed è risultato essere efficace contro tutti i virus testati (inclusi membri di tutte le famiglie virali conosciute, di interesse medico e veterinario). Il composto risulta essere leggermente corrosivo ma sono necessari brevi tempi di contatto perché abbia efficacia, risulta essere di conseguenza un prodotto sicuro. Il Virkon è il solo disinfettante con uno spettro d’azione tale da poter essere usato “ad occhi chiusi” quando il patogeno non sia ancora stato individuato. Possiede inoltre le caratteristiche di un agente decontaminante. Le sue caratteristiche lo rendono, di conseguenza, un disinfettante particolarmente adatto per il controllo delle emergenze sanitarie.
Il Virkon è inoltre classificato come un tensioattivo biodegradabile, ai sensi della Direttiva Comunitaria 73/404, poiché costituito da sali organici.
L’acido peracetico come disinfettante ossida le membrane esterne delle cellule dei microorganismi. Il meccanismo di ossidazione consiste nel trasferimento di elettroni. Quando si usa un ossidante più forte, gli elettroni vengono trasferiti ai microorganismi molto più velocemente, inducendo il microorganismo ad essere velocemente disattivato. In commercio si trovano soluzioni preconfezionate di acido peracetico, ovvero miscele in equilibrio di perossido di idrogeno e acido acetico. L’acido peracetico ha attività biocida molto buona, disattiva anche virus e spore e agisce anche in condizioni di “sporco”. Esplica azione più efficace quando il pH è 7 rispetto a un range tra 8 e 9. Dà origine ad una azione ossidativa irreversibile, è corrosivo, incolore, con un caratteristico odore pungente.
Poiché la manipolazione e lo stoccaggio sono difficili, è possibile ovviare creando acido peracetico in situ mediante perossosale e attivatore, anche se non si riescono ad ottenere soluzioni acide poiché la reazione è troppo lenta. Allo stato puro è esplosivo e la sua instabilità è favorita dalle alte temperature o dalla presenza di ioni di metalli pesanti. Alle concentrazioni d’uso non è nocivo, tuttavia è considerato potenzialmente co-cancerogeno.
| Microorganismi | Efficacia |
|---|---|
| Batteri Gram Positivi | + + + |
| Batteri Gram Negativi | + + + |
| Miceti | + + + |
| Virus Idrofili | + + |
| Virus Lipofili | + + |
| Micobatteri | + + |
| Spore | + + |
| SPETTRO D’AZIONE | |
|---|---|
| Microorganismi | Efficacia |
| Batteri Gram Positivi | + + |
| Batteri Gram Negativi | + + + |
| Miceti | + |
| Virus Idrofili | + |
| Virus Lipofili | + |
| Micobatteri | + - |
| Spore | - |
Sistemi di disinfezione no-touch che producono perossido di idrogeno includono:
Sono efficaci su una vasta gamma di microorganismi, inclusi batteri e virus.
Il completo processo di decontaminazione impiega da 3 a 5 ore.
Questi sistemi hanno molti limiti:

Inoltre, diversi materiali (ad esempio lino, tessuti di arredo,…) possono influenzare l’efficacia di questi sistemi. Per ottenere la massima disinfezione, questi sistemi necessitano di essere posizionati correttamente e che il riscaldamento, la ventilazione e l’impianto di condizionamento siano spenti per tutto il periodo di operatività dei sistemi.
Alcuni studi evidenziano il buon funzionamento del vapore di perossido di idrogeno, nella riduzione del livello di contaminazione batterica sulle superfici, se utilizzato dopo le procedure routinarie di pulizia e disinfezione, comparato con la sola procedura di pulizia e disinfezione.
| Sostanza | Potenziale redox (V) |
|---|---|
| Fluoro | 2,87 |
| Idrossiradicale (OH¯) | 2,86 |
| Ione persolfato (S₂O₈²¯) | 2,60 |
| Ossigeno atomico (O) | 2,42 |
| Ozono (O₃) | 2,07 |
| Perossido di idrogeno (H₂O₂) | 1,78 |
| Cloro (Cl) | 1,36 |
| Diossido di cloro (ClO₂) | 1,27 |
| Molecola di ossigeno (O₂) | 1,23 |
Il principale meccanismo di azione dell’ozono, è la perossidazione lipidica, che genera composti biologicamente attivi che a livello cellulare causano danni ai fosfolipidi di membrana. La tossicità dell’ozono dipende, inoltre, dalla sua capacità di ossidare gli amminoacidi alterando irreversibilmente la struttura e la funzione delle proteine. Gli amminoacidi più sensibili all’azione dei radicali liberi sono prolina, istidina, quelli contenenti gruppi tiolici (cisteina e metionina) e gruppi aromatici (fenilalanina, tirosina, triptofano).
Per quanto riguarda l’inattivazione dei virus, invece, è noto che anch’essa avviene rapidamente in seguito ad ozonizzazione, anche se richiede una somministrazione di gas a concentrazioni superiori rispetto a quella necessaria per i batteri. Si è osservato, infatti, che le curve di inattivazione mostrano un rapido abbattimento delle colture fino al 99%; il restante 1% richiede un tempo maggiore per la totale inattivazione. Vari studi effettuati sulla sensibilità dei virus all'ozono hanno dimostrato che i virus provvisti di membrana sono nettamente più sensibili di quelli che ne sono sprovvisti.
Il meccanismo di azione dell'ozono sui virus non è sicuramente quello di una distruzione, come nel caso dei batteri, ma di un'inattivazione; l'azione dell'ozono consisterebbe in un’ossidazione, e conseguente inattivazione, dei recettori virali specifici utilizzati per la creazione del legame con la parete della cellula da invadere. Verrebbe così bloccato il meccanismo di riproduzione virale a livello della sua prima fase: l’invasione cellulare.
Di seguito, la tabella di inattivazione dei microorganismi in seguito ad ozonizzazione:
| Organismo | Concentrazione | Tempo di esposizione |
|---|---|---|
| Batteri | 0,23 ppm – 2,2 ppm | < 20 min |
| Virus | 0,2 ppm – 4,1 ppm | < 20 min |
| Muffe | 2 ppm | 60 min |
| Funghi | 0,02 ppm – 0,26 ppm | < 1,67 min |
In Italia, il Ministero della Sanità con protocollo del 31 Luglio 1996 n°24482, ha riconosciuto l’utilizzo dell’ozono nel trattamento dell’aria e dell’acqua, come presidio naturale per la sterilizzazione di ambienti contaminati da batteri, virus, spore, muffe ed acari.
L’efficacia dell’ipoclorito è maggiore in un range di pH tra 6 e 9 e diminuisce marcatamente in presenza di materiale organico. Le soluzioni di ipoclorito sono chimicamente instabili e decompongono rapidamente quando la temperatura supera i 15°C.
Le soluzioni di ipoclorito hanno ampio spettro di attività ma numerose controindicazioni; nello specifico:
| Spettro d'azione | |
|---|---|
| Microorganismi | Efficacia |
| Batteri Gram Positivi | + + + |
| Batteri Gram Negativi | + + + |
| Miceti | + + + |
| Virus Idrofili | + + |
| Virus Lipofili | + + |
| Micobatteri | + + |
| Spore | + + |
| Spettro d'azione | |
|---|---|
| Microorganismi | Efficacia |
| Batteri Gram Positivi | + + + |
| Batteri Gram Negativi | + + + |
| Miceti | + + |
| Virus Idrofili | + + |
| Virus Lipofili | + + |
| Micobatteri | + + |
| Spore | + |
I principali tipi di disinfettanti organici sono:
composti organici a reazione neutra derivati da un idrocarburo nel quale un atomo di idrogeno H è costituito da un ossidrile OH. Sono liquidi, incolori, facilmente evaporabili, infiammabili, miscelabili in H₂O. L’azione antibatterica degli alcooli deriva dalla loro capacità di denaturare le proteine; tale capacità si esplica in presenza di H₂O.
| Spettro d'azione | |
|---|---|
| Microorganismi | Efficacia |
| Batteri Gram Positivi | + + + |
| Batteri Gram Negativi | + + + |
| Miceti | + + |
| Virus Idrofili | + - |
| Virus HIV | + + + |
| Virus Lipofili | + + |
| Micobatteri | + - |
| Spore | - |
Sono derivati dalla distillazione del catrame. I derivati del fenolo più in uso sono quelli che si ottengono per sostituzione di uno o più atomi di idrogeno H con:
L’azione si esplica come potenti veleni protoplasmatici.

Sono efficaci contro batteri Gram Positivi e Gram Negativi, virus di classe A, Micobatteri (in particolare il Mycobacterium tuberculosis) e Miceti. Sono meno efficaci contro virus di classe B e C e spore. Relativamente poco corrosivi. Il tempo di contatto dovrebbe superare i 10 minuti. Essi vengono assorbiti dalla gomma e da alcune plastiche. I fenoli hanno odore fastidioso, sono lievemente tossici e possono causare irritazioni.
Sono scarsamente stabili, i derivati del fenolo danno una maggior sicurezza rispetto al fenolo pur mantenendo lo stesso spettro d’azione.
Tra i derivati del fenolo, uno dei più utilizzati per la disinfezione è il derivato sintetico ORTOFENILFENOLO.
Sono composti solubili che riducono la tensione superficiale fra due liquidi o fra un solido ed un liquido. Nella loro struttura molecolare sono presenti due gruppi: uno idrofilo e uno idrorepellente. In base alla ionizzazione o meno del gruppo idrofilo, i tensioattivi sono classificati in:

| Spettro d'azione | |
|---|---|
| Microorganismi | Efficacia |
| Batteri Gram Positivi | + + + |
| Batteri Gram Negativi | + |
| Miceti | + - |
| Virus Idrofili | - |
| Virus Lipofili | - |
| Micobatteri | - |
| Spore | - |
Sostanza basica che forma Sali con gli acidi organici e inorganici. I Sali più usati sono:
La Clorexidina presenta ampio spettro d’azione antibatterica su Gram Positivi e Gram Negativi, agisce contro la Candida, non è sporicida ed esercita una semplice attività batteriostatica contro i batteri acido-resistenti e fungistatica. È debolmente attiva sui virus non capsulati e sui virus di classe A, praticamente inattiva sui virus capsulati (B e C) e sui micobatteri. I batteri acido-resistenti sono generalmente inibiti ma non uccisi. Le spore batteriche generalmente non vengono uccise, ma la germinazione viene inibita in quando le spore vengono in contatto con la Clorexidina.
A 98 – 100°C ed in soluzione alcoolica, essa è attiva sia su spore che sui batteri acido-resistenti e sui miceti.
Agisce sulla permeabilità della parete cellulare facendo precipitare i costituenti citoplasmatici. Determina infatti alterazioni di membrana con perdita dei componenti citoplasmatici (azione batteriostatica); ad alte concentrazioni produce coagulazione delle proteine citoplasmatiche (azione battericida). È maggiormente efficace in presenza per valori di pH tra 5 e 7.
Viene inattivata dal perossido di idrogeno e precipita in presenza di anioni (si trovano nell’acqua corrente) e di tracce di sapone e alcali.
È necessario preparare le soluzioni con acqua distillata e deionizzata. Non è tossica e ha rapida azione battericida. Il tempo di contatto dovrebbe superare i 5 minuti.
| Spettro d'azione | |
|---|---|
| Microorganismi | Efficacia |
| Batteri Gram Positivi | + + + |
| Batteri Gram Negativi | + + |
| Miceti | + |
| Virus Idrofili | - |
| Virus Lipofili | + |
| Micobatteri | + - |
| Spore | - |
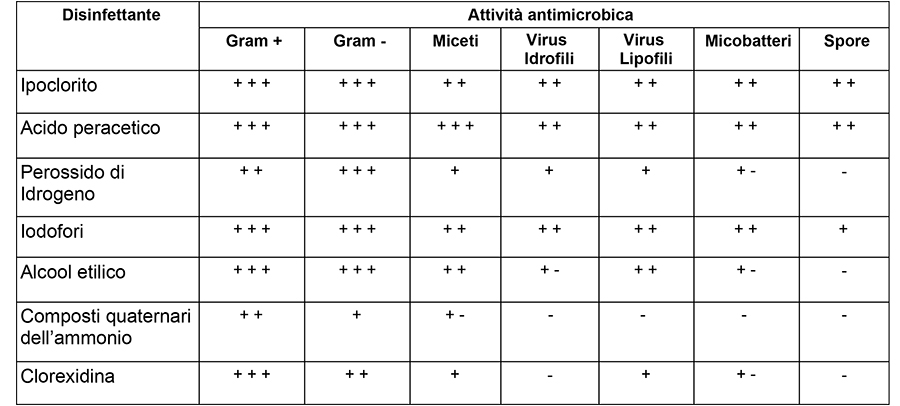
| Disinfettante | Attività antimicrobica | ||||||
|---|---|---|---|---|---|---|---|
| Gram + | Gram - | Miceti | Virus Idrofili | Virus Lipofili | Micobatteri | Spore | |
| Ipoclorito | + + + | + + + | + + | + + | + + | + + | + + |
| Acido peracetico | + + + | + + + | + + + | + + | + + | + + | + + |
| Perossido di Idrogeno | + + | + + + | + | + | + | + - | - |
| Iodofori | + + + | + + + | + + | + + | + + | + + | + |
| Alcool etilico | + + + | + + + | + + | + - | + + | + - | - |
| Composti quaternari dell’ammonio | + + | + | + - | - | - | - | - |
| Clorexidina | + + + | + + | + | - | + | + - | - |